
以下文章來源于至境程 ,,作者至境程
2024年5月11日,國家藥監(jiān)局組織修訂發(fā)布了《體外診斷試劑分類目錄》(以下簡稱《分類目錄(2024版)》),。在沿用原有《6840體外診斷試劑分類子目錄(2013版)》(以下簡稱6048)和《關(guān)于發(fā)布〈體外診斷試劑分類規(guī)則〉的公告》(國家藥品監(jiān)督管理局公告2021第129號,,(以下簡稱《分類目錄(2021版)》)的基礎(chǔ)上,做出了較大的調(diào)整【1-3】,。
我整理了24版《分類目錄》的變化,,并就個人的理解,分享我所理解的政策所指向的未來趨勢和將受政策影響較大的一些細分行業(yè),。個人理解存在較大局限性,,僅供參考(藍色字體均為個人觀點)。

一,、新版結(jié)構(gòu)調(diào)整:新增一二級分類
《分類目錄》結(jié)構(gòu)由2013版的五項,,調(diào)整為六項,“一級序號,、一級產(chǎn)品類別,、二級序號,、二級產(chǎn)品類別、預(yù)期用途,、管理類別”六個部分,。請見圖1 《分類目錄(2024版)》與6048的對比。
《6048體外診斷試劑分類子目錄(2013版)》
《分類目錄(2024版)》
圖1 《分類目錄(2024版)》與6048的對比
目錄按照管理類別由高到低的順序進行排序:一級目錄01-07為第三類體外診斷試劑,,共計7個,;08-19為第二類體外診斷試劑,共計12個,,20-25為第一類體外診斷試劑,,共計5個。
第二,、三類分類上依據(jù)《分類目錄(2021版)》設(shè)立的分類并維持不變,。
二、一級分類增加三個
第一類體外診斷試劑從原有3個,,增加到5個,,分別為:
1)僅提供輔助診斷信息的流式細胞儀用單一抗體試劑及同型對照抗體(一級目錄序號23,共62個)
2)僅提供輔助診斷信息的免疫組化用單一抗體試劑(一級目錄序號24,,共438個)
3) 僅提供輔助診斷信息的原位雜交用單一探針試劑(一級目錄序號25,,共122個)
并且在17號文第九條中,特別強調(diào)了只有流式細胞儀用,、免疫組化,、原位雜交產(chǎn)品涉及“單一抗體”或“單一探針”可以按照第一類管理。第一類的“單一抗體”或“單一探針”組合后,,作為第二類或第三類管理,。
《分類目錄》中未包含的組合產(chǎn)品,如組合后的預(yù)期用途僅為單項產(chǎn)品預(yù)期用途的組合,,應(yīng)當按照所包含的單項產(chǎn)品的最高管理類別確定其管理類別,。如有新增預(yù)期用途,應(yīng)當按照相關(guān)要求申請分類界定,。
(1)雙染及多染產(chǎn)品作為第二類或第三類管理
這說明隨著多色免疫熒光染色,,免疫組化雙染、多染及多色熒光原位雜交等技術(shù)的發(fā)展,,監(jiān)管部門應(yīng)該是已經(jīng)注意到了,,由于各省分類界定缺乏統(tǒng)一標準,導(dǎo)致有一些免疫組化廠家按照一類管理備案形式已經(jīng)拿到了免疫組化雙染,、三染的備案證,;而一些省份的雙染、三染產(chǎn)品通過省局上報國家局申請分類界定,被界定為二類或三類,。24版的分類新規(guī)意味著已有拿一類證的雙染,、三染產(chǎn)品從2027年1月1日起全部要按照作為第二類或第三類管理。
這個界定標準,,可能是從風險性上考慮的,。從技術(shù)角度,多探針,、多抗體在同一試劑盒中進行不同靶點檢測,可能存在信號之間互相干擾的問題,,對試劑的阻斷劑,,顯色劑,抗體的種屬性,、特異性有著較高要求,,對試劑的靈敏度、特異性等性能指標有著較高要求,,是需要提供臨床數(shù)據(jù)與現(xiàn)有單染產(chǎn)品進行對比驗證的,。
(2)以“微珠”或者“微球”為載體的檢測試劑至少按照第二類管理,將加強對細胞治療相關(guān)檢測的管理力度
24版的新規(guī)中明確:通過捕獲體液中其他成分形成生物粒子,、從而用流式細胞儀進行檢測的體外診斷試劑,,不符合《分類規(guī)則》中“流式細胞儀用單一抗體”有關(guān)要求,如在流式平臺上,,基于抗原抗體反應(yīng),,以特定“微珠”或者“微球”為載體,對白介素,、干擾素,、腫瘤壞死因子等物質(zhì)進行檢測分析的試劑。該界定邏輯遵循了“只有‘單一抗體’或‘單一探針’可以按照第一類管理”的邏輯,。
在流式檢測中使用“微珠”或“微球”,,“微珠”或者“微球”磁珠的粒徑、表面積大小及其均勻程度都將影響其檢測性能和可重復(fù)性,,磁珠與抗體的偶聯(lián)工藝及抗原,、抗體質(zhì)量更是影響磁珠捕獲效率的關(guān)鍵因素。
為什么強調(diào)是對白介素,、干擾素,、腫瘤壞死因子的檢測?
白介素,、干擾素,、腫瘤壞死因子的檢測固然與多種疾病的診斷、預(yù)后、療效相關(guān),。但什么特別強調(diào)此三種細胞因子使用磁珠的檢測至少要按第二類以上管理,?
另外,12個流式細胞儀配套用產(chǎn)品由一類升為二類管理,,具體包括:α-干擾素檢測試劑,、γ-干擾素檢測試劑、白介素-1β檢測試劑,、白介素2檢測試劑,、白介素4檢測試劑、白介素5檢測試劑,、白介素6檢測試劑,、白介素8檢測試劑、白介素10檢測試劑,、白介素17檢測試劑,、白介素12p70檢測試劑、腫瘤壞死因子α檢測試劑,。
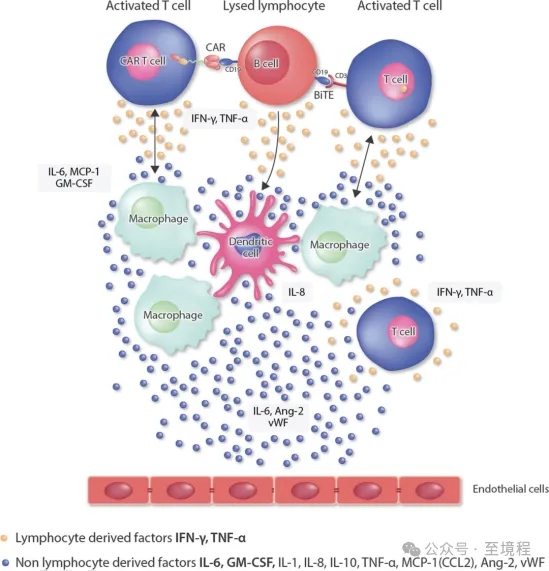
圖2 CRS的發(fā)生機制【4】
熟悉細胞治療行業(yè)的人,,對細胞因子釋放綜合征(CRS)肯定不陌生。CRS是CAR-T治療后最常見的嚴重不良反應(yīng),。CAR-T細胞療法輸注患者體內(nèi)后,,誘導(dǎo)IFN-γ或TNF-a的釋放,巨噬細胞和內(nèi)皮細胞產(chǎn)生大量IL-6,,而IL-6以正反饋的方式激活T細胞和其他免疫細胞,,導(dǎo)致CRS的發(fā)生,引起全身炎癥反應(yīng)以及組織器官的嚴重損傷,。在CAR-T輸注及預(yù)處理過程中,,監(jiān)測IFN-γ、TNF-α,、IL-6,、IL-8和GM-CSF等細胞因子的水平和變化,有利于CAR-T治療后CRS的早期診斷,,及時干預(yù)和療效監(jiān)測,。
提高此三種細胞因子使用磁珠的檢測的管理級別,有利于杜絕一些細胞治療廠家,,在開展CAR-T細胞治療臨床實驗時,,以一類備案證形式將相應(yīng)的檢測試劑盒入院,向臨床入組病人收取入組前的檢測費用,,或?qū)z測費用納入醫(yī)保范圍增加醫(yī)保負擔,。
三,、24版對預(yù)期用途描述更為詳細,根據(jù)臨床用途劃分類別
“預(yù)期用途”涉及的內(nèi)容比6048更為詳細,,包括被測物及主要臨床用途等,。
個人覺得是強調(diào)了主要臨床用途,使用此表格查詢時更為方便,,可以根據(jù)臨床用途和涉及的臨床疾病名稱,,在表格中進行搜索查詢。
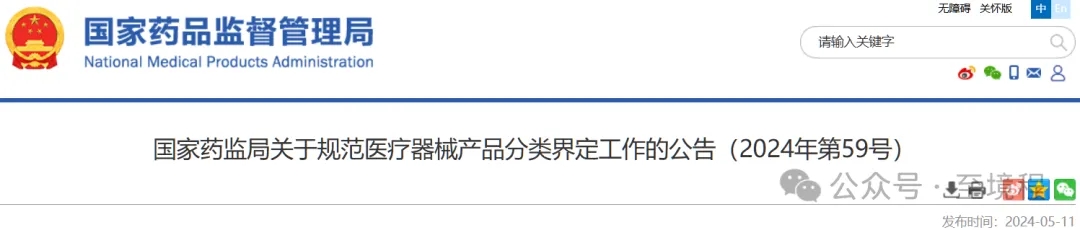
圖3中列出的相同被測物依據(jù)用途不同管理級別不同的對比表格可以看出,,低類別條目的預(yù)期用途描述中,,都明確寫了“不用于”高類別管理的預(yù)期用途。強調(diào)的內(nèi)容,,意味以后在舉報和監(jiān)管“低級別產(chǎn)品違規(guī)涉高級別用途操作”時有據(jù)可循,,未來的監(jiān)管力度會加強。
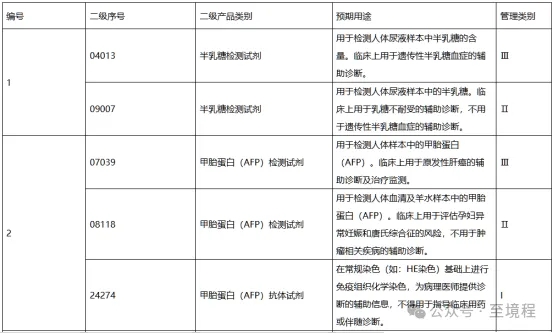
圖3 相同被測物依據(jù)用途不同管理級別不同
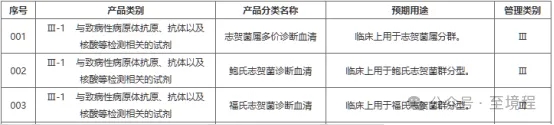
四,、24版增加二級序號,查詢更為簡便
二級序號為每一個產(chǎn)品類別的唯一編碼,,編碼規(guī)則為從左到右第一,、二位是“一級類別序號”,后三位是在該一級類別中的序號,。不同的“一級類別序號”都從后三位“001”開始計數(shù),。也就是說每個類別中最后一個只要看它的編碼,就知道該類別有多少個產(chǎn)品了,,使用起來非常簡便,。
例如:下圖中第三列的5為數(shù)字,一看就是為一級目錄中第25個,。它又是最后一個產(chǎn)品的編碼,,所以25類產(chǎn)品“僅提供輔助診斷信息的原位雜交用單一探針試劑”共計有122個。

五,、對培養(yǎng)基的分類,,將影響細胞治療和腫瘤類器官藥敏檢測
明確了僅基礎(chǔ)培養(yǎng)基產(chǎn)品可按照第一類管理的細胞培養(yǎng)基,如RPMI-1640 培養(yǎng)基,,并根據(jù)《分類規(guī)則》明確用途限制(不用于細胞治療,、細胞回輸、輔助生殖等非體外診斷用途),。
括弧里面的內(nèi)容是關(guān)鍵,。隨著腫瘤類器官技術(shù)的發(fā)展,各種專家共識和行業(yè)標準的推出,,基于腫瘤類器官培養(yǎng)基的分類界定已經(jīng)在24年被國家局界定為三類,。
這次重申對于已備案的明確所培養(yǎng)的細胞類型、細胞來源,但不能明確其預(yù)期用途的細胞培養(yǎng)基產(chǎn)品,,不列入《分類目錄》,,如上皮細胞培養(yǎng)基、腫瘤細胞培養(yǎng)基,、結(jié)直腸細胞培養(yǎng)基,、肝細胞培養(yǎng)基、骨髓細胞培養(yǎng)基等,。相關(guān)產(chǎn)品應(yīng)當明確預(yù)期用途后申請分類界定,,依據(jù)用途界定管理級別,以后會是總原則,。
【引用文獻】
【1】國家藥監(jiān)局關(guān)于實施《體外診斷試劑分類目錄》有關(guān)事項的通告(2024年第17號)https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20240511171642107.html
【2】國家藥監(jiān)局關(guān)于發(fā)布體外診斷試劑分類目錄的公告(2024年第58號)
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20240511172028171.html
【3】國家藥監(jiān)局關(guān)于規(guī)范醫(yī)療器械產(chǎn)品分類界定工作的公告(2024年第59號)
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20240511175941109.html
【4】Jorge Garcia Borrega,Philipp G?del,Maria Adele Rüger, et al. In the Eye of the Storm: Immune-mediated Toxicities Associated With CAR-T Cell Therapy. HemaSphere. 2019;3 (2):e191-e191. doi:10.1097/hs9.0000000000000191.



